Существуют некоторые стационарные состояния атома, находясь в которых он не излучает и не поглощает энергии. Этим стационарным состояниям соответствуют вполне определенные (стационарные) орбиты.
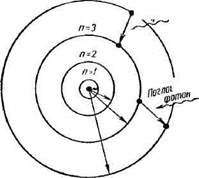
Орбита является стационарной, если момент количества движения электрона (L = mm) кратен h/2π = И, т.е. L = mvr = nħ, где n = 1, 2, 3, . -целые числа.
3. При переходе атома из одного стационарного состояния в другое испускается или поглощается один квант энергии hvnm=Wn-Wm где Wn, Wm - энергия атома в двух стационарных состояниях, h - постоянная Планка, vnm - частота излучения. При Wn > Wm происходит излучение кванта, при Wn < Wm - его поглощение.
*♦ . Это был переворот, пусть пока не
 «S*WU окончательный, во взглядах физиков на атом. "* Его дальнейшим углублением явилась квантовая механика.
«S*WU окончательный, во взглядах физиков на атом. "* Его дальнейшим углублением явилась квантовая механика.
Эти постулаты Бор использовал для расчета *** простейшего атома (водорода), рассматривая первоначально наиболее простую его модель: неподвижное ядро, вокруг которого по круговой орбите вращается электрон. Объяснение спектра водорода было большим успехом Рис. 7. Модель атома Бора теории Бора.
Квантовые постулаты Бора были лишь первым шагом в создании теории атома, поэтому пришлось воспользоваться следующим приемом: сначала задача решалась при помощи классической механики (заведомо неприменимой полностью к внутриатомным движениям), а затем из всего непрерывного множества состояний движения, к которым приводит классическая механика, на основе квантовых постулатов отбирались квантовые состояния. Несмотря на все несовершенство этого метода, он привел к большим успехам - позволил объяснить сложные закономерности в атомных и молекулярных спектрах, осмыслить природу химических взаимодействий и др. Такой подход, по сути, является частным случаем общего принципа, играющего важную роль в современной
теоретической физике - принципа соответствия, который гласит, что всякая неклассическая теория в соответствующем предельном случае переходит в классическую.
Важным достижением Бора и других исследователей было развитие представления о строении многоэлектронных атомов. Предпринятые шаги в развитии теории строения более сложных (чем водород) атомов и объяснении структуры их спектров принесли некоторые успехи, однако здесь исследователи столкнулись с большими трудностями. Введение четырех квантовых чисел, характеризующих состояния электрона в атоме, установление принципа Паули (согласно которому две тождественный частицы с полуцелым спином не могут одновременно находиться в одном состоянии) и объяснение периодической системы Менделеева - большие успехи теории атома Бора.
Прочие статьи:
Групповое обучение в несемейных группах.
Обучение в несемейных группах (кратко — групповое обучение) происходит в стаях и стадах животных, в их временных скоплениях, в их территориальных группах и сообществах. Значение этих групп, и в частности стай, весьма многогранно. Пожалу ...
Макроструктура клонированной вставки
Для определения макроструктуры вставки сначала устанавливают ее размер и положение сайтов для рестриктирующих эндонуклеаз. Поскольку клонированные фрагменты геномной ДНК часто бывают длиннее или короче, чем интересующая нас область, необх ...
Гуморальная регуляция
Гипоталамо-гипофизарная система представлена двумя взаимосвязанными структурами – гипоталамусом и гипофизом посредством портальной сосудистой системы.
Гипоталамическая область связана афферентными путями со спинным, продолговатым и средн ...

