A+B®C
V=kCA·CB
C в молях на литр, k – коэффициент.
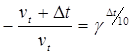
g - температурный коэффициент реакции, g=2…4
Правило Вант-Гоффа: При повышении температуры на 10° скорость реакции увеличивается в 2-4 раза.
Vt+Дt=60
Vt=40.
Скорость реакции зависит от энергии активации молекул.
Энергия активации – это так энергия, которая необходима молекуле, чтобы вступить в реакцию.
Eакт=40 кДж/моль (реакция нейтрализации)
Еакт=40-2000 кДж/моль (Например, N2+O2).
Огромное большинство химических реакций обратимы. Обратимость реакций мешает производству. Ле Шателье (188) вывел правило смещения равновесий: Если на систему, находящуюся в состоянии химического равновесия подействовать извне, то равновесие сместится в том направлении, которые ослабляют это воздействие. Изменяется температура, концентрация, давление.
![]()
1. Смещение равновесия из-за изменения концентрации любого вещества, участвующего в реакции.
2. Смещение равновесия вследствие изменения температуры реакции.
3. Смещение равновесия вследствие изменения давления.
Катализ – изменение скорость реакции под действием веществ, называющихся катализаторами, которые участвуют в химической реакции но остаются химически неизменными.
Катализ может быть положительным, то есть, скорость реакции увеличивается, а может быть отрицательным, скорость замедляется. В этом случае вещество называется не катализатором, а ингибитором.
Если продукты реакции, катализатор и реагенты находятся в одной фазе (газ, жидкость, твердое), то реакции называются гомогенными, если нет, то гетерогенными. Катализатор снижает энергию активации и увеличивает число активных молекул. Если катализатор ввести в обратимую реакцию, то он повышает скорость прямой и обратной реакции одинаково. Катализатор не смещает равновесие.
Электрокатализ – реакции идут на поверхности электродов.
Фотокатализ – когда используется энергия поглощенного излучения (фотосинтез, многие реакции получения полимеров).
Ферментативный катализ – под действием ферментов (биокатализаторов). Другое название ферментов – энзимы, а наука о них – энзимология. Отличие ферментов от промышленных катализаторов: ферменты – белковые молекулы, включающие небольшое количество комплексов металлов, от которых зависит активность фермента. Фермент работает при физиологической температуре и давлении. Он долго работает без регенерации. Они расходуются в течение жизни. Ферментативное ускорение реакции – в десятки и сотни миллионов раз!!! Одна молекула фермента за одну минуту способна превратить 36 000 000 молекул исходных элементов. Природные ферменты способны к самоорганизации. Недостаток ферментов: живут только внутри клетки, вне ее разрушаются спустя несколько минут; при высокой температуре происходит денатурация, у каждого из них своя среда.
В энзимологии возникло три направления:
1. Очистка природных ферментов.
2. Разработка искусственных ферментов.
3. Моделирование работы живой клетки.
Полимеры
На современном этапе синтетическая химия – это химия полимеров. Они бывают природные, синтетические и искусственные. Природные: белки, нуклеиновые кислоты, клетчатка, кожа, каучук, шёлк – продукты жизнедеятельности организмов; многие минералы. В 1974 году Вакрамасиндхе обнаружил полимер формальдегида в облаках межзвездной пыли. H-COH. Полимерное состояние вещества – одна из форм существования материи во вселенной. Искусственные полимеры – из природных материалов – ацетатное волокно, искусственный шёлк, искусственный каучук. Синтетические – из неорганических или простых органических веществ. Аналога в природе не имеют. Используют реакции полимеризации и поликонденсации для получения всех типов полимеров. Полимеризация – много мономеров соединяются в цепочку. Очень чувствительны к примесям, выделить вещество на определенной промежуточной стадии реакции невозможно. Поликонденсация – постепенное присоединение мономеров. Значит, реакцию можно остановить на каком-либо этапе, получив промежуточные вещества. Реакции поликонденсации не слишком чувствительны к примесям. Все природные полимеры получаются реакцией поликонденсации. Реакция поликонденсации сыграла большую роль в эволюции живых организмов (белки, нуклеиновые кислоты). Реакция полимеризации в природе не существует. К настоящему времени получено около пятисот тысяч различных полимеров. Самые важные из них, «три кита» - полиэтилен, полистирол и поливинилхлорид.
Прочие статьи:
Этология сов. Взаимоотношение различных видов сов
между собой
Во время наблюдений за отдельными парами сов, заселивших наши искусственные гнездовья, нами были отмечены также несколько случаев пересечения кормовых угодий различных пар сов одного или разных видов. Отчасти это было перекрывание с парам ...
Технологическая схема микробиологического синтеза уксусной кислоты
На рис. 7 изображена технологическая схема микробиологического синтеза уксусной кислоты. Римскими цифрами обозначены основные материальные потоки, арабскими цифрами обозначено технологическое оборудование.
I. – посевной материал;
II. ...
Проблемы биологической адаптации человека
Адаптация (позднелат. «adaptatio» – приспособление, приспособляемость) – это совокупность морфофункциональных, поведенческих и других особенностей данного вида, обеспечивающих возможность специфического образа жизни в конкретных условиях ...

