Законы показывают переходы теплоты в работу. Изобретение паровых машин подтолкнуло развитие термодинамики. В 1848 году Джоуль впервые рассчитал эквивалент теплоты и работы 1 кал=4,187 Дж.
Термодинамическая система – это система, состоящая из большого числа частиц, взаимодействующих между собой. Термодинамические системы могут быть:
· Изолированными (замкнутыми) – это те системы, которые не сообщаются с окружающей средой ни работой, ни теплом, ни веществом, ни информацией. Другое название – равновесные.
· Открытые – сообщающиеся с окружающей средой. Открытые системы не изучаются классической термодинамикой.
Для замкнутых систем можно было применить наиболее простые расчётные уравнения, которые в некотором приближении подходили к описанию работы двигателей и тепловых машин. Параметры термодинамической системы: объем(V), работа(A), давление(P), температура(T), теплота(Q), внутренняя энергия тела(U).
Т является производной от энергии. Запас энергии всегда положителен, так как нельзя прекратить тепловое движение молекул, даже при Т=0 К остаются колебательные и вращательные движения.
Q – одна из форм энергии, определенное количество энергии, получаемое или передаваемое системой.
А определяется силой действия на систему. А=F·S, A=PДV.
U включает в себя запас энергии атомов, молекул, электронов…
U=Uпоступ движ молек+Uядер+Ue+…
Без учёта Ек и Еп системы в целом!
Классическая термодинамика описывается тремя законами:
1. Закон сохранения и превращения энергии.
Q=ДU+A, где ДU – изменение внутренней энергии.
Количество теплоты, сообщенное телу, идет на увеличение его внутренней энергии и совершение телом работы.
Q=ДU+PДV.
2. Невозможно получить работу без затрат энергии, то есть, невозможен вечный двигатель первого рода. Универсальный закон природы, справедливый для живых и неживых объектов.
1 кг жира ® 38,9 кДж
1 кг углеводов ® 17,5 кДж
1 кг белков ® 17,5 кДж
Применение первого закона к изопроцессам.
1. Изохорный, V=const. A=0, Q= ДU
2. Изобарный, P=const. Q=ДU+PДV
3. Изотермический, T=const. ДU=0, Q=A.
4. Адиабатный (протекающие без теплообмена), чаще всего – это быстротекущие процессы. Q=const. A=-ДU
Теплоёмкость ![]() - это количество теплоты, сообщенное телу и изменяющее при этом температуру тела на 1°С . Второй закон термодинамики рассматривает возможность и направление наблюдаемого процесса. Все самопроизвольные процессы идут в направлении выравнивания системы, и они всегда приводят к состоянию равновесия. Несамопроизвольный процесс идет только при воздействии извне.
- это количество теплоты, сообщенное телу и изменяющее при этом температуру тела на 1°С . Второй закон термодинамики рассматривает возможность и направление наблюдаемого процесса. Все самопроизвольные процессы идут в направлении выравнивания системы, и они всегда приводят к состоянию равновесия. Несамопроизвольный процесс идет только при воздействии извне.
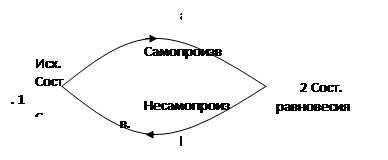

Это реальный необратимый процесс.
Обратимый процесс – это когда при его завершении (возврате в исходное состояние) система самопроизвольно возвращается к этому состоянию без каких-либо потерь. Это гипотетический цикл. К обратимому циклу можно приблизиться, если сделать процесс бесконечно медленным. Все обратимые процессы равновесны. На основании обратимого цикла С. Карно в 1827 году разработал так называемый цикл Карно – цикл работающей тепловой машины. Рабочее тело в цикле Карно – идеальный газ, и при работе такого цикла в машине нет потерь на трение, лучеиспускание и т.п. Тепловая машина, или тепловой двигатель, - это такое устройство, которое превращает внутреннюю энергию топлива в механическую.
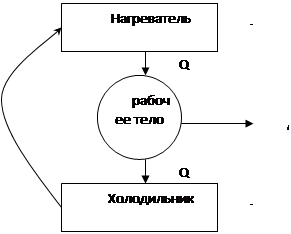

Рабочее тело (газ, пар) при расширении совершает работу, при этом получает от нагревателя теплоту Q1. Далее сжимается, при сжатии рабочее тело передаёт холодильнику теплоту Q2. (Q1<Q2, T2<T1).


1-2 – изотермическое расширение газа с температурой T1. При этом газ получает от нагревателя Q1.
2-3 – дальнейшее расширение идеального газа с понижением температуры (адиабатное расширение).
В первых двух процессах совершается работа А.
3-4 – изотермическое сжатие.
4-1 – адиабатное сжатие газа с повышением температуры с T2 до Т1.
Прочие статьи:
Градостроительство на дне моря
Хорошо известно, что осьминоги ловко переносят щупальцами различные камни. Камни служат им материалом для постройки гнезд и даже щитами при отражении вражеских атак.
Когда нет готовых квартир, осьминоги строят их сами таким образом: стас ...
Годичные биоритмы
Годичные, или цирканнуальные биологические ритмы имеют период колебания 1 год ± 2 месяца и связаны с вращением Земли вокруг Солнца.
Эти ритмы наблюдаются у всех организмов от полярной до тропической зоны. Выраженность годовых (сезонных) ...
Биохимический метод
С помощью биохимических методов определяется многочисленная группа наследственных патологий, например, более 150 различных ферментопатий. Создаются штаммы микроорганизмов с таким условием, что при отсутствии какого-либо конкретного фермен ...

