Особенностью метаболизма глутамата в нервной ткани является его тесная связь с интенсивно функционирующим в этом органе циклом трикарбоновых кислот, что и позволяет считать его промежуточным продуктом энергетического метаболизма. Так, уже через 30 мин после инъекции меченой глюкозы более 70% радиоактивности растворимой фракции приходится на долю глутамата и его производных. Этому способствует чрезвычайно быстрое взаимопревращение глутамата и а-кетоглутарата в ЦНС. Высокий процент включения радиоактивности из глюкозы в аминокислоты мозга явился основанием для предположения, что утилизация глюкозы в этом органе в значительной степени происходит через биосинтез и окисление аминокислот.
Непосредственным предшественником для синтеза глутамата в мозге является а-кетоглутаровая кислота, которая может превращаться в глутамат или путем прямого восстановительного аминирования с участием глутаматдегидрогеназы, или путем переаминирования.
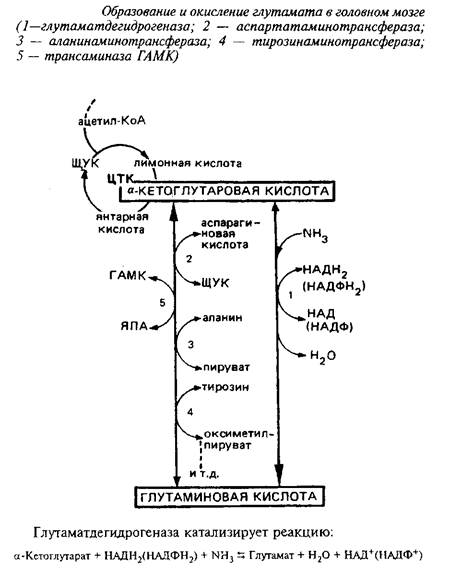
Энзим менее активен в мозге, чем в печени, присутствует в митохондриях, требует в качестве кофакторов пиридиннуклеотидов и активируется АДФ. Км этого энзима для аммония близок к 8 мМ. Реакция обратима, однако равновесие сильно сдвинуто в сторону прямой реакции, т.е. синтеза глутаминовой кислоты.
Таким образом, в головном мозге глутаматдегидрогеназная реакция участвует не столько в окислении глутамата, сколько в синтезе его из а-кетоглутаровой кислоты, обеспечивая тем самым непрерывное превращение свободного аммиака в аминоазот аминокислот. Основной же путь окисления глутамата в мозге - через переаминирование.
В митохондриях мозга 90% глутамата подвергается переаминированию с образованием аспартата. Фермент, катализирующий переаминирование глутамата с щавелевоуксусной кислотой, - аспартатаминотрансфераза является наиболее мощной трансаминазой головного мозга. Выделены два изоэнзима аспартатаминотрансферазы, локализованных в митохондриях и цитоплазме. Функциональная роль их различна. Митохондриальный фермент связан в основном с функционированием ЦТК, цитоплазматический определяет интенсивность глюконеогенеза.
Как уже отмечалось, путь метаболизма глутамата через переаминирование намного активнее дегидрогеназного. В регуляции соотношения между этими двумя путями, конкурирующими за один субстрат, важная роль принадлежит макроэргическим соединениям. В интактных митохондриях энзим взаимодействует по преимуществу с НАДФ+ и интенсивность реакции пропорциональна отношению НАДФ+/НАЦФН2. Макроэргические соединения способствуют превращению НДЦФ+ в НАДФН2 и тем самым подавляют дезаминирование глутамата. Наоборот, трансаминазный путь требует расходования макроэргических соединений. Поэтому выбор между этими двумя реакциями определяется энергетическими возможностями митохондрий.
При нормальном функционировании ЦТК дегидрогеназный путь окисления глутамата подавлен, а трансаминазный активно протекает. В результате уменьшения количества макроэргических соединений, например при добавлении к митохондриям разобщителя окислительного фосфорилирования 2,4-динитро-фенола, подавляется трансаминазный путь при одновременном резком усилении дегидрогеназного пути окисления глутамата.
Прочие статьи:
Вихревое мышление
Четвертый когнитивный стиль: мышление синтетическое, позитивное, индуктивное. В этих формах протекает мышление ES (ЭСЭ), SP (СЛИ), PT (ЛИЭ) и TE (ИЭИ). Наиболее подходящее название этого мышления — вихревое, или синергетическое. Синергети ...
Приготовление образцов ДНК для электрофореза
ДНК, получаемая обычным способом, обладает достаточно хорошим качеством для проведения анализа методом геномной дактилоскопии. Наилучшие результаты получают, если на дорожку приходится 1–5 мкг ДНК. Поскольку имеет значение не только прису ...
Конституция и раса
В учении о типах человеческой конституции было много извращений, ряд зарубежных ученых считали возможным подразделять индивидов в зависимости от их конституционального габитуса на полноценных и неполноценных.
Подобные попытки были подвер ...

