Очевидно, структурная специфичность для процесса узнавания не играет существенной роли. Однако необходимо помнить, что изменение свободной энергии менее чем на 5 ккал/моль соответствует изменению сродства в 1000 раз. Такое различие в сродстве вполне может быть обусловлено тонкими различиями между функциональными и нефункциональными сигнальными последовательностями. Моделью рецептора сигнального пептида может служить растворимый фрагмент антигена гист©совместимости класса I, а именно HLA-A2, трехмерная структура которого известна. Этот белок связывается с пептидами — компонентами чужеродных антигенов, что является
частью иммунного ответа. Область связывания пептида представляет собой большой желобок, открытый с одного конца и способный вмещать пептид из 20 аминокислотных остатков, если тот имеет форму а-спирали. О пептидах, которые могут связываться с HLA-A2, известно немного; показано, в частности, что близкородственный антиген гист©совместимости класса II проявляет высокое сродство к самым разным аминокислотным последовательностям. По-видимому, наиболее важными ббщими характеристиками пептидов, которые могут связываться с высоким сродством, являются вторичная структура и амфифильность. Стабилизации комплекса могут способствовать многочисленные взаимодействия в области связывания.
Известно, что относительно небольшие различия между сигнальными последовательностями порождают огромные различия в поведении белка. Например, если сигнальная последовательность не распознается сигнальной пептидазой, то белок чаще остается связанным с мембраной, чем секретируется, хотя есть и исключения из этого правила. Обычно сигнальные последовательности, которые служат также N-концевыми якорями,
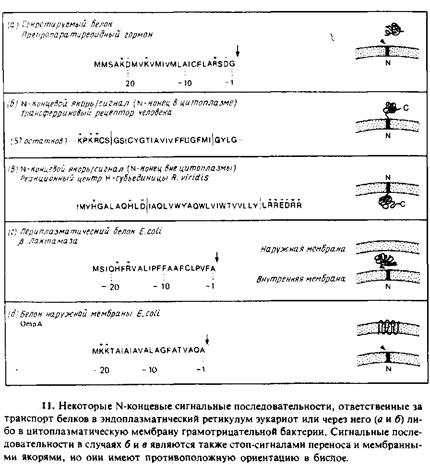
имеют более протяженный гидрофобный h-участок длиной около 20 аминокислотных остатков; этот участок необходим для остановки переноса и/или образования стабильного якоря в мембранном бислое. Примером такой сигнальной/якорной последовательности служит трансферриновый рецептор. Заметим, что в этом случае сигнальная последовательность расположена не иа N-конце, а на расстоянии более чем 50 аминокислотных остатков от него.
Известны также случаи, когда сигнальная последовательность закрепляет зрелый белок в противоположной ориентации, т. е. N-конец оказывается обращенным наружу. В качестве примера можно привести цитохром Р450 микросом крысы, инвариантную церь антигенов гистосовместимости класса II мыши, несколько вирусных белков и Н-субъединицу реакционного центра R. viridis. Каким-то образом эти сигналь-ные/якориые последовательности «проталкивают» свой N-коиец через мембрану и останавливают трансляцию, так что основная часть белка остается в цитоплазме. Отмечалось, что в некоторых из этих случаев сигнальные последовательности «старт/стоп» несут, по крайней мере, одни отрицательный заряд в n-области. Однако для встраивания указанных мембранных белков, как и белков обычного типа, используется одинаковый аппарат переноса — СРЧ. Возможно, наличие отрицательного заряда облегчает самопроизвольный или опосредованный белком перенос N-концевых остатков через мембрану.
Как мы уже отмечали, сигнальные последовательности не обязательно находятся на N-конце белковой молекулы и могут направлять перенос обоих фланкирующих домеиов, по крайней мере в случае искусственных гибридных белков. Уникальным примером такого рода является овальбумин, секреция которого детерминируется неотщепляемой внутренней сигнальной последовательностью. У многих мембранных белков эндоплазматического ретикулума неотщепляемые сигнальные последовательности тоже расположены в средней части полипептидиой цепи и играют роль трансмембраниых якорей. В качестве примера можно привести асиалогликопротеиновый рецептор. Внутренняя сигнальная последовательность этого белка использует тот же аппарат переноса, что и N-концевая последовательность; и действительно, в искусственных гибридах эта внутренняя сигнальная последовательность функционирует как обычная N-концевая последовательность. Примерами белков с внутренней неотщепляемой сигнальной последовательностью, которые имеют многочисленные трансмембраниые сегменты и N-конец которых находится на внутренней стороне мембраны, служат переносчик глюкозы и анионный переносчик белок полосы 3. Напротив, у опсина, тоже содержащего внутренний неотщепляемый сигнальный пептид, N-конец находится с наружной стороны мембраны. Этот внутренний сигнал протягивает гидрофильный аминокислотный домеи через мембрану, и, таким образом, его ориентация противоположна той, которая наблюдается в более общем случае при переносе полипептида, начиная с С-конца. Причина такого поведения опсина неизвестна; возможно, важную роль играет природа N-концевого пептида.
Прочие статьи:
Масс-спектрометрический анализ смесей дейтерий меченных аминокислот
белковых гидролизатов B. methylicum.
Общие принципы изучения степени дейтерированности аминокислот при данном способе введения метки были также продемонстрированы на примере анализа сложных мультикомпонентных смесей, полученных после гидролиза белка биомассы. В качестве прим ...
Классификация белков
Сложность строения белковых молекул, чрезвычайное разнообразие выполняемых ими функций затрудняют создание единой и четкой их классификации, хотя попытки сделать это предпринимались неоднократно, начиная с конца 19 века. Исходя из химичес ...
Основные методики. Оборудование
Реакции обычно проводят в 0,5- или 1,5 мл микроцентрифужных пробирках Эппендорф. Оборудование для нагрева и охлаждения может быть совсем простым и состоять всего лишь из набора водяных бань с различной температурой воды, или очень сложным ...

